Diabete
Le cause reversibili dell’arresto cardiaco sono note come 5I (Ipossia, Ipovolemia, Ipo/Iperkaliemia, Ipotermia, Idrogenioni [acidosi]) e 5T (Trombosi coronarica o polmonare, Pneumotorace iperteso, Tamponamento cardiaco, Tossici, Trauma). Per questo motivo, tutti gli sforzi durante le manovre di rianimazione cardiopolmonare avanzata devono essere tesi alla risoluzione della causa sottostante l’arresto cardiaco, mediante somministrazione di farmaci o l’esecuzione di manovre più o meno invasive. Alla luce di ciò, il trattamento dell’ipoglicemia potrebbe essere preso in considerazione, in quanto è stato dimostrato come un’ipoglicemia severa possa indurre arresto cardiaco. Tuttavia, la somministrazione di glucosio durante la rianimazione cardiopolmonare non è contemplata di routine.
Correlazione tra ipoglicemia ed arresto cardiaco
I decessi dovuti a grave ipoglicemia sono stati mediati dalla neuroglicopenia cerebrale e dalla risposta simpatico-surrenale che porta ad aritmie cardiache fatali, le quali causano insufficienza cardiaca seguita da arresto respiratorio.
Il tasso di morte improvvisa nei giovani con diabete di tipo 1 è 10 volte superiore a quello dei soggetti di controllo della stessa età e le morti notturne improvvise rappresentano fino al 27% di tutte le morti inspiegabili nelle persone con diabete di tipo 1.
La cosiddetta “sindrome del morto a letto” identifica individui giovani altrimenti sani con diabete di tipo 1 che sono stati trovati morti a letto senza una chiara causa di morte; per questi è stato ipotizzato che la loro morte fosse dovuta all’eccessiva somministrazione di insulina che ha provocato una grave ipoglicemia.
Tuttavia, i meccanismi attraverso i quali l’ipoglicemia grave può essere letale non sono chiari.
Durante l’ipoglicemia, la mancanza di apporto di glucosio ai neuroni può portare a confusione, danni cerebrali, convulsioni e persino alla morte. Infatti, il 6-10% dei decessi nei giovani con diabete di tipo 1 è direttamente attribuibile all’ipoglicemia. È stato ipotizzato che le aritmie cardiache improvvise contribuiscano alla morte improvvisa indotta da ipoglicemia grave.
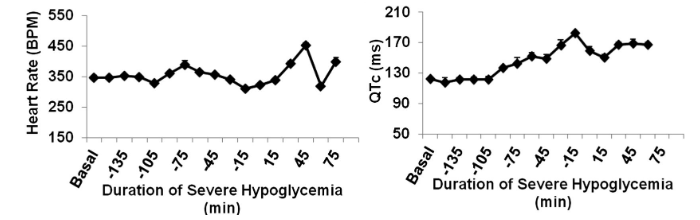
Studi clinici che hanno analizzato gli elettrocardiogrammi hanno rilevato che le aritmie cardiache associate al prolungamento dell’intervallo QTc si verificano durante l’ipoglicemia moderata. Il prolungamento dell’intervallo QTc rappresenta la dispersione della depolarizzazione ventricolare e può portare ad un aumento del rischio di aritmie cardiache fatali.
Nel contesto dell’ipoglicemia grave indotta da insulina, non è noto se le aritmie cardiache fatali siano mediate dalla neuroglicopenia cerebrale di per sé o da fattori sistemici che agiscono direttamente sul cuore.
A livello sistemico, è stato ipotizzato che sia il decremento dei livelli di potassio indotto dall’insulina sia l’aumento indotto dalla controregolazione dei livelli di catecolamine contribuiscano alle aritmie. È stato inoltre precedentemente dimostrato che la somministrazione di potassio o di β-bloccanti possa ridurre le aritmie cardiache lievi durante l’ipoglicemia moderata (~45 mg/dL). Tuttavia, resta ancora da determinare se la prevenzione dell’ipokaliemia o il blocco delle azioni delle catecolamine protegga dalle aritmie letali e dall’arresto cardiorespiratorio durante l’ipoglicemia grave.
Risultati degli studi condotti sugli animali
Al fine di determinare le cause prevenibili di morte durante l’ipoglicemia, sono stati condotti alcuni studi nei ratti che prevedevano l’esecuzione di severi boli ipoglicemici con prelievo simultaneo di sangue arterioso e monitoraggio ECG. È stato ipotizzato che la neuroglicopenia cerebrale e la marcata risposta simpatico-surrenale durante l’ipoglicemia grave inneschino aritmie cardiache fatali.
Mortalità
Per comprendere come il diabete e l’ipoglicemia ricorrente potrebbero influire sulla sopravvivenza durante l’ipoglicemia grave, i dati aggregati sono stati analizzati da ratti non diabetici, diabetici non controllati e ipoglicemici moderati ricorrenti prima che diventassero ipoglicemici gravi.
I livelli di glucosio basale per i ratti non diabetici, diabetici e ipoglicemici ricorrenti erano rispettivamente di 88 ± 5, 348 ± 37 e 74 ± 2 mg/dL. Durante la prima ora di ipoglicemia, i livelli di glucosio erano simili per i ratti di controllo (12 ± 0,2 mg/dL), diabetici (12 ± 0,2 mg/dL) e con ipoglicemia ricorrente (12 ± 0,4 mg/dL). Come previsto, i ratti con ipoglicemia ricorrente presentavano una ridotta risposta dell’epinefrina all’ipoglicemia (2.001 ± 241 vs. 3.487 ± 474 pg/mL nei controlli).
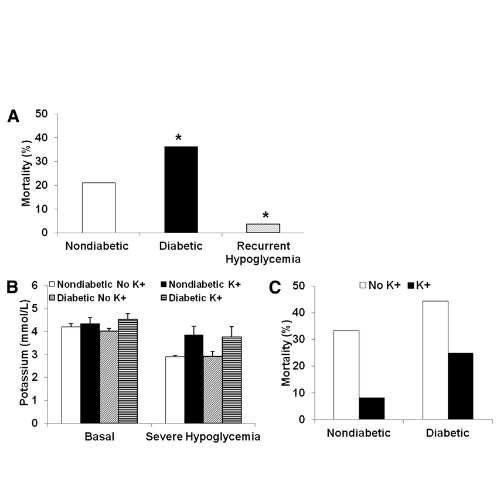
Durante l’ipoglicemia grave, tutti i ratti hanno perso il riflesso di raddrizzamento, sono entrati in coma e hanno sperimentato una breve attività simile a una crisi epilettica. La mortalità dovuta a grave ipoglicemia era del 21% nei ratti non diabetici e aumentata al 36% nei ratti diabetici (P <0,05).
È interessante notare che i ratti che erano stati precedentemente trattati con ipoglicemia moderata ricorrente avevano una mortalità notevolmente inferiore (4%) durante l’ipoglicemia grave (P <0,05). Si ipotizzava che le differenze nei tassi di mortalità fossero dovute a ipokaliemia, neuroglicopenia o risposta simpatico-surrenale, ognuna delle quali può avere una maggiore suscettibilità alle aritmie cardiache.
Somministrazione di potassio
Al fine di determinare se la causa della morte dovuta a grave ipoglicemia derivasse da ipokaliemia, il potassio è stato integrato in ratti non diabetici e diabetici durante un bolo ipoglicemico grave della durata di un’ora. I ratti di controllo avevano livelli di glucosio basale rispettivamente di 127 ± 7 mg/dL e 116 ± 12 mg/dL con o senza supplementazione di potassio.
I livelli di glucosio basale per i ratti diabetici erano rispettivamente di 479 ± 77 mg/dL e 394 ± 54 mg/dL. I livelli medi di glucosio durante l’ipoglicemia grave non erano diversi tra i ratti non diabetici che ricevevano (12,6 ± 1,18 mg/dL) o non (12,5 ± 0,76 mg/dL) il potassio o i ratti diabetici che lo ricevevano (12,1 ± 0,84 mg/dL) o che non hanno ricevuto potassio (13,4 ± 0,39 mg/dL).
I livelli di potassio sono diminuiti durante l’ipoglicemia grave sia nei ratti non diabetici (da 4,2 ± 0,15 a 2,9 ± 0,06 mmol/L) sia nei ratti diabetici (da 4,0 ± 0,11 a 2,9 ± 0,23 mmol/L) che non hanno ricevuto potassio.
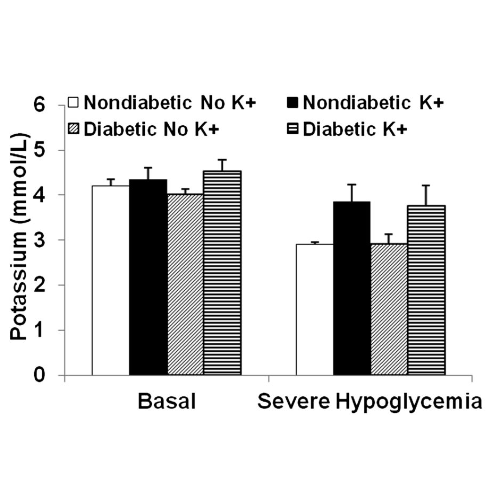
Dall’ipoglicemia basale a quella grave, l’integrazione di potassio ha mantenuto i livelli plasmatici di potassio nei ratti non diabetici (da 4,4 ± 0,26 a 3,9 ± 0,38 mmol/L) e diabetici (da 4,5 ± 0,25 a 3,8 ± 0,47 mmol/L).
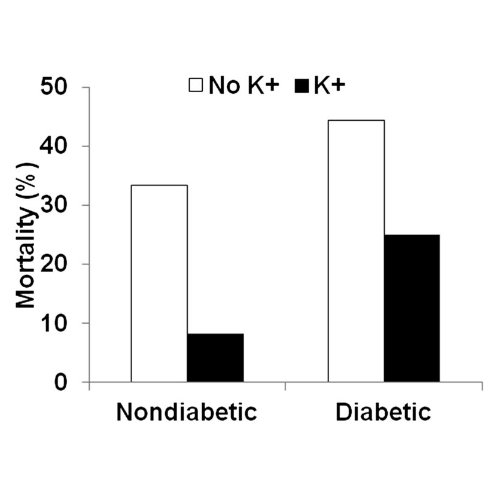
La mortalità associata a grave ipoglicemia tendeva a ridursi con l’integrazione di potassio rispetto ai ratti che non ricevevano potassio sia nei ratti non diabetici (dal 33 all’8%) che diabetici (dal 44 al 25%) (P <0,08).
Aritmie cardiache, saturazione periferica dell’ossigeno, pressione arteriosa e modificazioni nell’EEG
La morte grave indotta da ipoglicemia sembrava essere correlata alla condizione proaritmica dovuta all’ipokaliemia; pertanto, è stato ipotizzato che le aritmie cardiache mediassero la mortalità indotta da ipoglicemia grave.
I ratti non diabetici (n = 6) sono stati sottoposti a severi boli ipoglicemici con registrazione continua dell’ECG. I valori di glucosio sono stati bloccati tra 10-15 mg/dL per 90 minuti durante i quali tutti i ratti sono morti.
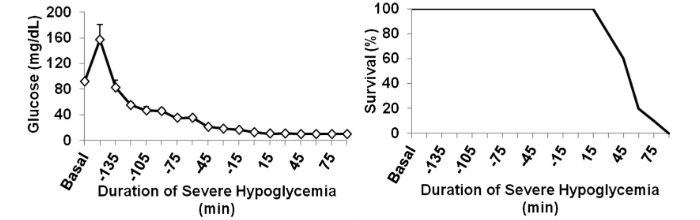
Durante l’infusione di insulina, la frequenza cardiaca è rimasta normale fino a quando non è aumentata all’inizio dell’ipoglicemia grave, la quale ha aumentato l’intervallo QTc (172 ± 8 ms) rispetto al basale (122 ± 2 ms), che rappresenta un aumento del 40% della fase di depolarizzazione e ripolarizzazione ventricolare (P <0, 001).
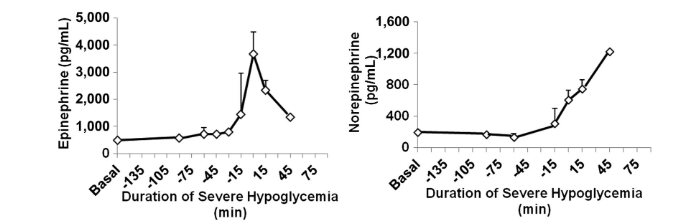
Inoltre, durante l’ipoglicemia grave sono aumentate l’adrenalina e la norepinefrina rispetto al periodo basale (P <0,001). L’epinefrina plasmatica ha raggiunto il picco poco dopo l’inizio dell’ipoglicemia grave e poi è diminuita mentre l’ipoglicemia grave continuava, probabilmente indicando un esaurimento surrenalico. La noradrenalina plasmatica ha continuato ad aumentare durante l’ipoglicemia grave.
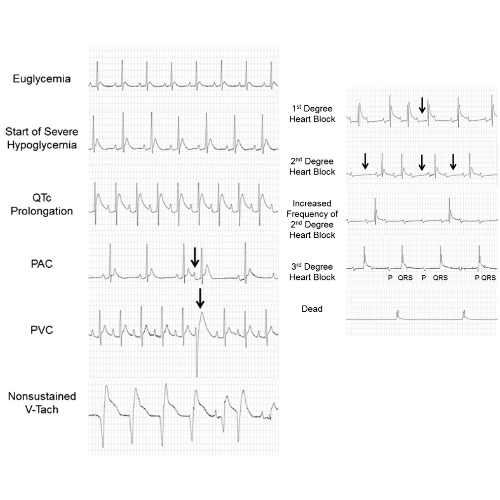
Durante l’ipoglicemia moderata non si sono verificate aritmie cardiache. Dopo l’inizio dell’ipoglicemia grave, sono state notate come aritmie iniziali le contrazioni ventricolari premature e il blocco cardiaco di secondo grado Mobitz II. Anche le contrazioni atriali premature e il blocco cardiaco di primo grado sono stati osservati come aritmie precoci.
Occasionalmente si sono verificati brevi periodi di tachicardia ventricolare non sostenuta, ma questi ritmi non hanno preceduto la morte. Con una durata più lunga dell’ipoglicemia grave, sono stati osservati un pattern sequenziale e una progressione delle aritmie che hanno preceduto la morte.
È stato notato un blocco cardiaco di secondo grado frequente e di grado superiore (4: 1) seguito da un blocco cardiaco di terzo grado (dissociazione atrioventricolare completa), caratterizzato da un ritmo ventricolare bradicardico terminale.
I livelli di ossigeno e anidride carbonica sono rimasti normali durante l’esperimento fino a poco prima della morte, quando i livelli di ossigeno sono diminuiti e i livelli di anidride carbonica sono aumentati. Come notato in precedenza, i livelli di potassio sono diminuiti durante l’ipoglicemia grave rispetto al basale (P<0,05).
La pressione arteriosa è aumentata da 105 ± 14/60 ± 2 mmHg durante il periodo basale a 177 ± 16/93 ± 9 mmHg durante l’ipoglicemia grave ed è rimasta elevata fino a immediatamente prima della morte, quando è improvvisamente diminuita.
In tutti i ratti è stata osservata un’attività simil-convulsiva. Un sottogruppo di ratti aveva registrazioni EEG simultanee durante il bolo. Durante l’ipoglicemia grave, i tracciati EEG hanno mostrato caratteristiche onde lente ad alta ampiezza. L’isoelettricità EEG coincideva con uno stato comatoso non reattivo.
Le convulsioni testimoniate coincidevano con picchi ad alta frequenza e ad alta ampiezza di maggiore attività elettrica sull’EEG. Non è stata trovata alcuna correlazione tra crisi epilettiche e mortalità.
Infusione intracerebroventricolare di glucosio
Per comprendere fino a che punto la neuroglicopenia media la morte improvvisa, il glucosio è stato infuso nel terzo ventricolo del cervello durante una grave ipoglicemia. Rispetto ai controlli, l’infusione di glucosio intracerebroventricolare ha ridotto la mortalità dovuta a grave ipoglicemia dall’86 al 33% (P<0,05).
La glicemia sistemica era simile durante l’ipoglicemia grave nei ratti infusi con mannitolo intracerebroventricolare (n = 9) e con glucosio intracerebroventricolare (n = 9) (rispettivamente 12 ± 0,1 vs. 12 ± 0,2 mg/dL)
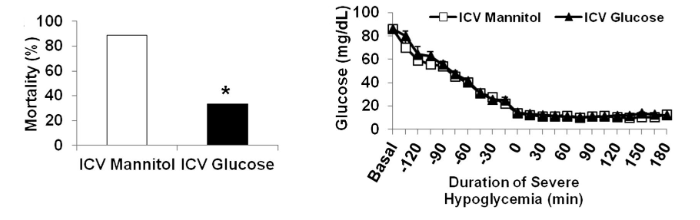
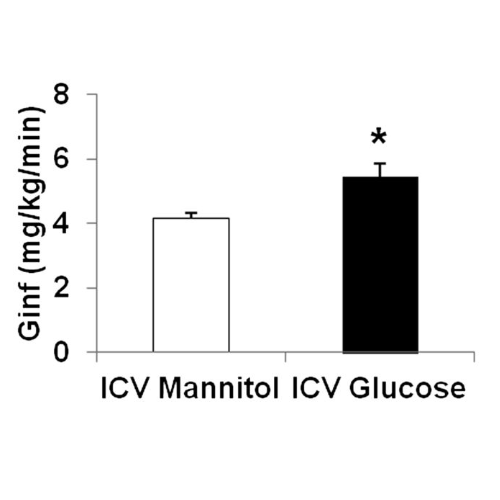
Nonostante i livelli di glucosio abbinati, il gruppo trattato con glucosio intracerebroventricolare richiedeva una velocità di infusione di glucosio periferico più elevata (5,4 ± 0,6 mg/kg/min; P <0,005) durante l’ipoglicemia grave rispetto al gruppo trattato con mannitolo (4,1 ± 0,41 mg/kg/min).
I livelli di insulina erano comparabili tra i gruppi mannitolo (7,5 ± 0,78 ng/mL) e glucosio (8,8 ± 0,49 ng/mL) durante l’ipoglicemia grave.
Durante l’ipoglicemia grave, la frequenza cardiaca era più bassa nel glucosio rispetto al gruppo trattato con mannitolo (P <0, 05).
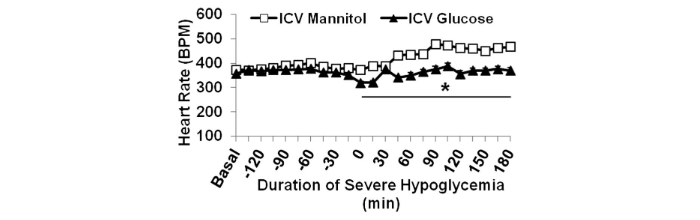
La frequenza cardiaca media è aumentata nel gruppo mannitolo durante l’ipoglicemia grave rispetto a quella basale (414 ± 9 vs. 373 ± 4 bpm; P <0,01), mentre l’infusione di glucosio intracerebroventricolare ha impedito questo aumento della frequenza cardiaca (basale: 357 ± 4 bpm; ipoglicemia: 357 ± 8 bpm). Il QTc è aumentato durante l’ipoglicemia grave rispetto al basale in entrambi i gruppi, mannitolo e glucosio (P = NS).
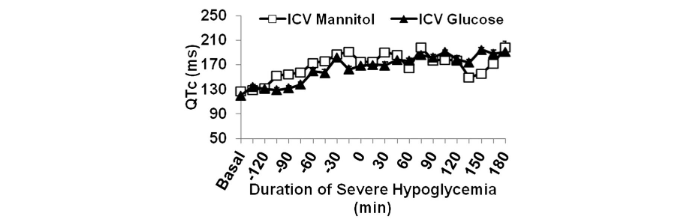
Le aritmie cardiache erano assenti nel 25% dei ratti infusi con glucosio intracerebroventricolari. Le frequenze di battiti prematuri ventricolari e di blocco cardiaco di secondo grado erano ridotte in modo non significativo nel glucosio rispetto al gruppo trattato con mannitolo (P<0,07).
L’incidenza del blocco cardiaco di terzo grado è stata ridotta nel gruppo glucosio rispetto al gruppo mannitolo (P<0, 05) e ha preceduto la morte in entrambi i gruppi, suggerendo che il blocco cardiaco di terzo grado era l’aritmia fatale terminale associata a grave ipoglicemia. Altre aritmie pericolose per la vita come la tachicardia ventricolare sono state osservate nel 33% del gruppo trattato con mannitolo e nello 0% del gruppo glucosio.
La risposta alla norepinefrina è stata attenuata durante una grave ipoglicemia nel gruppo glucosio (464 ± 48 pg/mL) rispetto al gruppo mannitolo (1.441 ± 646 pg/mL; P <0,05). Durante l’ipoglicemia grave, l’epinefrina è aumentata in misura simile sia nel gruppo mannitolo (1.926 ± 320 pg/mL) che nel gruppo glucosio (2.155 ± 448 pg/mL). Dall’ipoglicemia basale a quella grave, i livelli plasmatici di potassio sono diminuiti nei ratti trattati con mannitolo (da 4,7 ± 0,3 a 3,6 ± 0,4 mmol/L) e di glucosio (da 4,4 ± 0,3 a 3,1 ± 0,5 mmol/L).
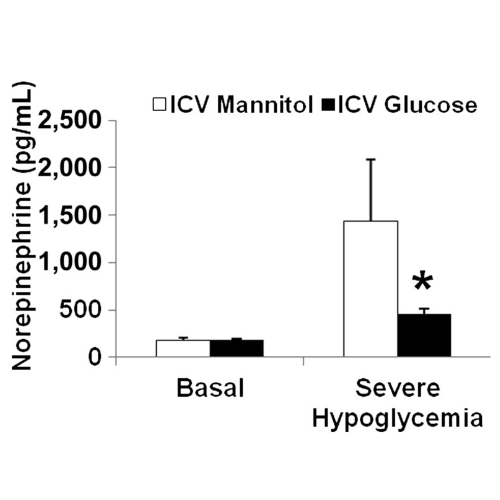
Blocco adrenergico
Per testare l’ipotesi che la risposta simpatico-surrenale aumenti il rischio di aritmie cardiache fatali durante l’ipoglicemia grave, i ratti sono stati infusi con bloccanti del recettore adrenergico durante un bolo iperinsulinemico/grave ipoglicemico.
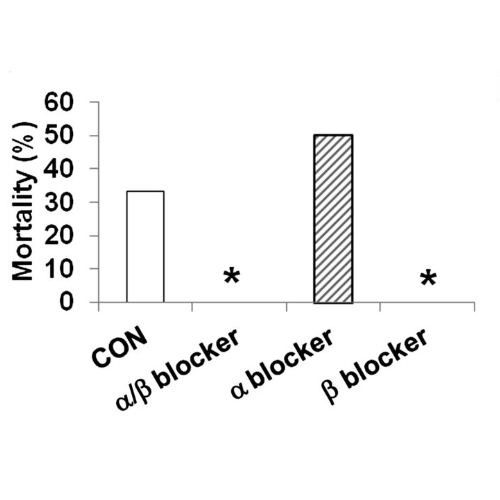
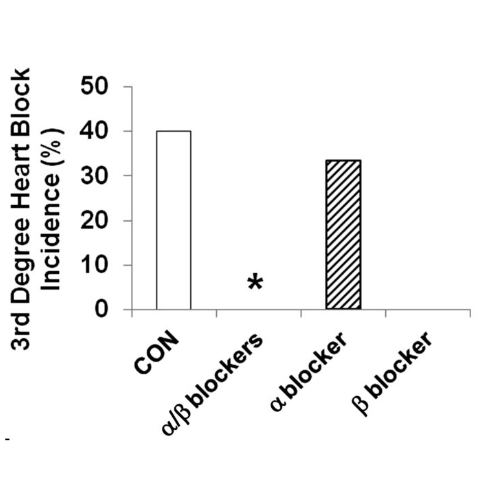
La mortalità indotta da ipoglicemia grave è stata del 33% nei ratti di controllo (n = 12), mentre l’infusione combinata di α/β-bloccante (n = 13) e la sola infusione di β-bloccante (n = 5) hanno prevenuto completamente la morte (P <0,029). L’infusione di α-bloccante da sola non ha avuto alcun effetto sulla mortalità (50%; n = 6).
I livelli di glucosio durante l’ipoglicemia grave erano ugualmente abbinati nei ratti di controllo, α/β-, α- e β-bloccanti (rispettivamente 12 ± 0,2, 12 ± 0,3, 12 ± 0,5 e 12 ± 0,5 mg/dL).
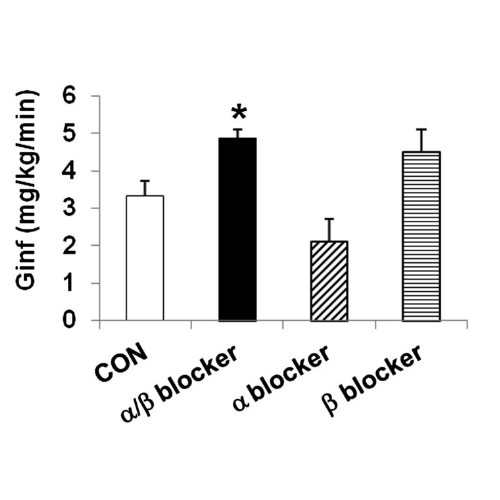
Coerentemente con una risposta controregolatoria smussata, la velocità di infusione del glucosio è aumentata durante l’ipoglicemia grave nei ratti infusi con α/β-bloccante (P<0, 01) rispetto ai controlli, senza alcuna differenza nel solo α- e β-bloccante– ratti infusi. I livelli di insulina non erano diversi tra i gruppi.
Durante l’ipoglicemia grave, la frequenza cardiaca era inferiore nei ratti infusi con α/β-bloccanti (225 ± 5 bpm) e nei ratti infusi con β-bloccanti (198 ± 4 bpm) rispetto ai controlli (331 ± 5 bpm) e nei ratti con infusione di α-bloccanti (339 ± 9 bpm) (P <0, 05).
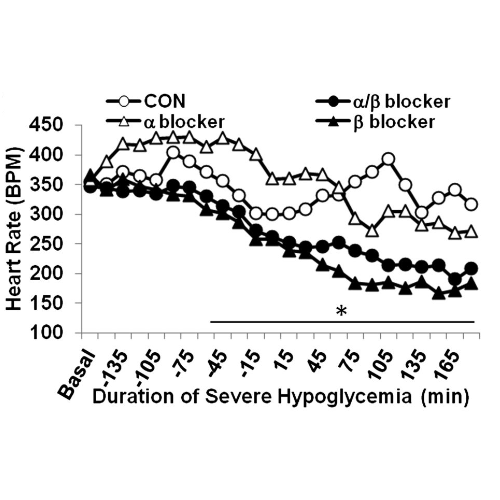
La tachicardia sinusale è stata riscontrata in tutti i ratti morti e più di 30 minuti di tachicardia hanno provocato una mortalità del 100%. Il β-bloccante e l’infusione combinata di α/β-bloccante hanno completamente abrogato la tachicardia e la mortalità indotte dall’ipoglicemia. La tachicardia sinusale è quindi un predittore di mortalità in questi esperimenti e la prevenzione della tachicardia è stata associata a un beneficio in termini di mortalità.
Il prolungamento dell’intervallo QTc è aumentato durante l’ipoglicemia grave nei ratti di controllo (163 ± 2 ms) con infusione di α-bloccanti (210 ± 5 ms) e con infusione di β-bloccanti (164 ± 2 ms) (P < 0,001), ma il prolungamento dell’intervallo QTc è stato smussato con infusione di α/β-bloccante (134 ± 3 ms; P <0, 001).
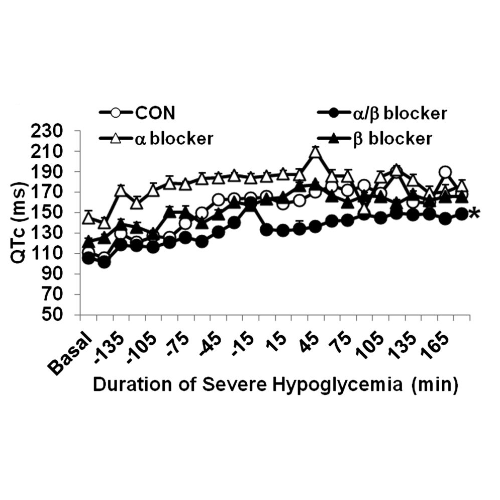
Il prolungamento dell’intervallo QTc era associato ad un aumentato rischio di mortalità nei ratti di controllo e α-bloccanti. È interessante notare che i ratti infusi con β-bloccanti avevano un prolungamento dell’intervallo QTc simile a quello dei ratti di controllo, ma tutti sono sopravvissuti, indicando che il prolungamento dell’intervallo QTc potrebbe non essere un mediatore diretto della grave letalità indotta dall’ipoglicemia.
L’incidenza di aritmie era inferiore con l’infusione di α/β- e β-bloccanti rispetto ai controlli. Battiti prematuri ventricolari e blocco cardiaco di secondo grado si sono verificati rispettivamente solo nel 25 e nell’8% dei ratti α/β-bloccanti (P < 0,001). La frequenza dei battiti prematuri ventricolari è stata ridotta nei ratti infusi con α/β e β-bloccanti rispetto ai controlli (P <0,001).
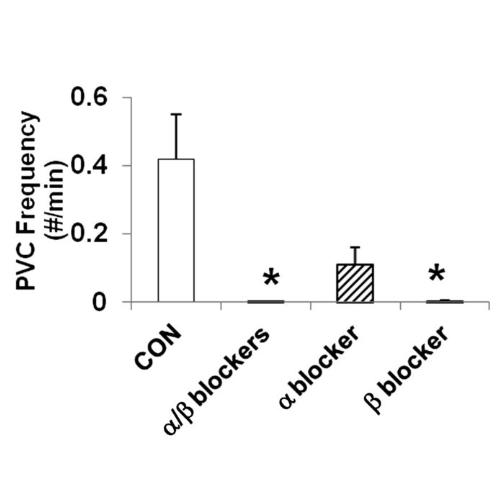
I ratti infusi con α-bloccanti avevano una frequenza non significativamente inferiore di battiti prematuri ventricolari. La frequenza del blocco cardiaco di secondo grado era significativamente ridotta nei ratti infusi con α/β-bloccanti combinati (P <0,001) e tendeva a ridursi nei ratti infusi con α- e β-bloccanti rispetto ai controlli.
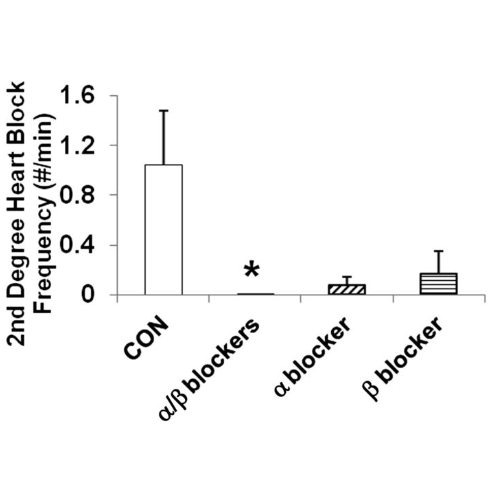
Il blocco cardiaco di terzo grado è stato prevenuto nei ratti infusi con α/β-bloccanti (P <0,024) e nei ratti infusi con β-bloccanti (P = NS), senza differenze nei ratti infusi con α-bloccanti rispetto ai controlli.
L’adrenalina e la noradrenalina sono aumentate significativamente durante l’ipoglicemia grave rispetto al basale in tutti i gruppi; tuttavia, le azioni dell’adrenalina e della norepinefrina sono state bloccate con i bloccanti adrenergici.
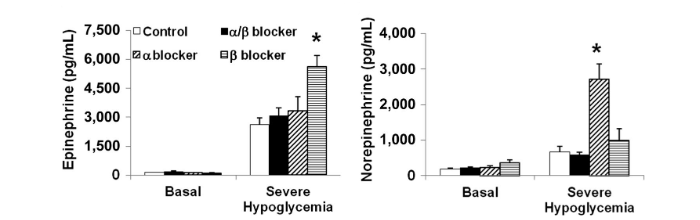
Coerentemente con la diminuzione della clearance dell’adrenalina da parte dei β-bloccanti, i livelli di adrenalina erano significativamente più alti nei ratti infusi con β-bloccanti rispetto ai controlli (P<0, 004) e ai ratti α / β-bloccanti (P <0, 011).
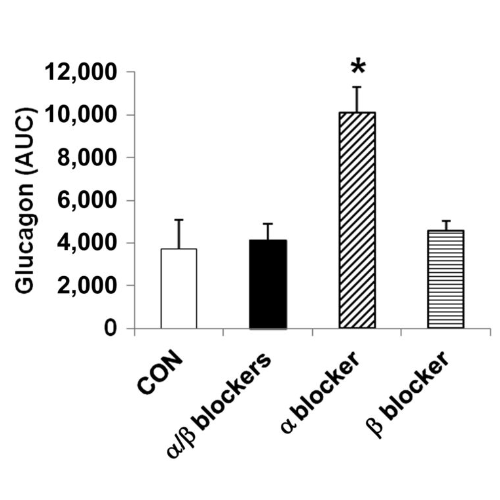
La noradrenalina era significativamente aumentata nel gruppo α-bloccante (P <0,001) rispetto ai gruppi di controllo, α/β- e β-bloccante. Il glucagone era significativamente più alto nei ratti infusi con α-bloccanti rispetto ad altri gruppi (P <0, 001 per ciascun gruppo), fatto questo coerente con l’elevata stimolazione del recettore β-adrenergico mediata dalla norepinefrina, incontrastata, delle cellule α pancreatiche.
I livelli di potassio sono diminuiti in tutti i gruppi durante l’ipoglicemia grave (P <0,01). I livelli di ossigeno e anidride carbonica sono rimasti normali in tutti i gruppi fino a poco prima della morte. Rispetto ai controlli, i tassi di respirazione erano più bassi nei ratti infusi con α/β-, α- e β-bloccanti durante l’ipoglicemia grave (P <0,001) e diminuivano precipitosamente immediatamente prima della morte.
La pressione sistolica media durante l’ipoglicemia grave per i ratti di controllo, α / β-, α- e β-bloccanti era rispettivamente di 133 ± 14, 140 ± 10, 129 ± 8 e 112 ± 4 mmHg. La pressione diastolica media durante l’ipoglicemia grave era rispettivamente di 91 ± 16, 90 ± 9, 92 ± 8 e 77 ± 4 mmHg. La pressione arteriosa sistolica e diastolica era significativamente più bassa nei ratti infusi con β-bloccanti (P <0,001).
Morte cardiaca improvvisa dovuta a grave ipoglicemia indotta da insulina
Sulla base delle osservazioni composite negli esperimenti presentati, i ricercatori hanno proposto quali siano i meccanismi di morte cardiaca improvvisa dovuta a grave ipoglicemia indotta da insulina.
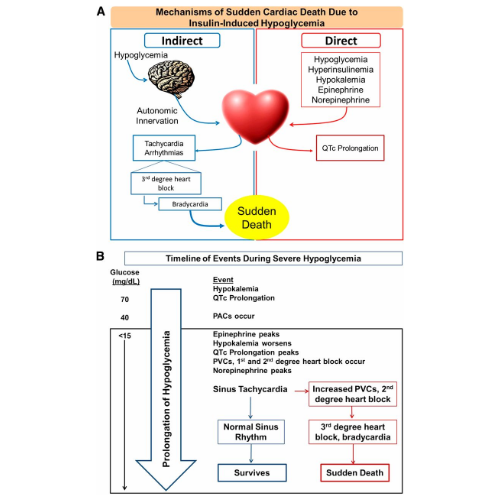
Nel contesto dell’ipoglicemia indotta da insulina, livelli alterati di nutrienti circolanti (glucosio), elettroliti (potassio) e ormoni (insulina, epinefrina e norepinefrina) possono avere un effetto aritmogeno diretto sul cuore.
Inoltre, poiché l’ipoglicemia viene rilevata a livello del cervello, gli effetti indiretti (cioè sul sistema nervoso centrale) dell’ipoglicemia contribuiscono anche alle aritmie cardiache fatali attraverso il sistema nervoso efferente e al rilascio locale di noradrenalina nei terminali nervosi all’interno del cuore.
L’innervazione autonomica della ghiandola surrenale provoca il rilascio di adrenalina. Sia l’adrenalina che la noradrenalina agiscono a livello del cuore per aumentare il rischio di aritmie cardiache fatali. Nel contesto della somministrazione di insulina, si ritiene che anche l’ipokaliemia contribuisca alle aritmie cardiache. Le azioni dirette e indirette sul cuore portano al prolungamento dell’intervallo QTc.
La morte cardiaca improvvisa indotta da ipoglicemia deriva da un aumento della segnalazione adrenergica a livello del cuore che porta alla tachicardia sinusale. La tachicardia è seguita da blocco cardiaco di terzo grado che culmina in un ritmo bradicardico fatale che causa insufficienza cardiorespiratoria e morte improvvisa.
In risposta a condizioni di iperinsulinemia, ma prima dell’inizio dell’ipoglicemia, è stato notato che si verificano ipokaliemia e prolungamento dell’intervallo QTc. Durante livelli moderati di ipoglicemia (∼40 mg/dL), le contrazioni atriali premature si verificano occasionalmente. All’inizio dell’ipoglicemia grave (15 mg/dL), l’epinefrina raggiunge il picco.
Con il prolungarsi dell’ipoglicemia grave, l’ipokaliemia peggiora, si sviluppano picchi di prolungamento dell’intervallo QTc e si sviluppano aritmie cardiache (battiti prematuri ventricolari e blocchi cardiaci di primo e secondo grado). La noradrenalina raggiunge il picco in circa 1 ora in una grave ipoglicemia ed è seguita da tachicardia sinusale.
Se la tachicardia è seguita da un ritorno al normale ritmo sinusale, il ratto sopravvive. Se la tachicardia è seguita da un aumento della frequenza dei battiti prematuri ventricolari e da un blocco cardiaco di secondo grado, si manifesterà un blocco cardiaco di terzo grado associato a bradicardia che porterà a morte cardiaca improvvisa.















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?